Kekhasan Atom Karbon
- Dapat Membentuk Empat Ikatan Kovalen
Kabon terletak pada golongan IVA dengan nomor atom 6. Dari konfigurasi elektron diketahui bahwa karbon memiliki 4 elektron valensi. Untuk memenuhi kaidah oktet atau duplet maka atom karbon memerlukan tambahan 4 buah elektron atau melepaskan 4 buah elektronnya untuk memenuhi kaidah duplet. Tetapi energi yang dibutuhkan untuk melepaskan 4 buah elektron lebih besar daripada energi yang dibutuhkan untuk menerima 4 elektron. Maka arom karbon lebih memilih menerima 4 buah elektron dibanding melepaskan 4 buah elektronnya.
- Kemampuan Membentuk Rantai
Di alam karbon dapat membentuk ikatan antar karbon berupa ikatan tunggal, rangkap dua atau rangkap tiga. Selain itu, atom karbon mempunyai kemampuan membentuk rantai ikatan yang panjang dengan rantai karbon bervariasi yaitu berupa rantai lurus, bercabang, bahkan atom karbon dapat membentuk senyawaan dalam bentuk melingkar (siklik).
Hidrokarbon
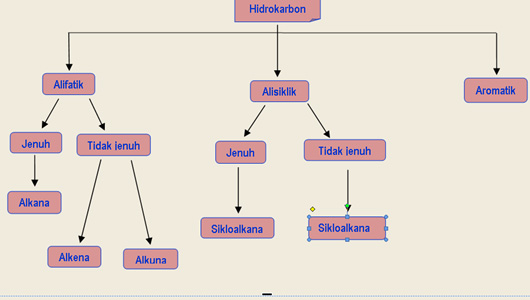
suatu senyawa dikatakan senyawa Hidrokarbon apabila senyawa yang tersusun oleh atom karbon (C) dan hidrogen (H). Hidrokarbon terbagi menjadi 3 kelompok yaitu hidrokarbon alifatik, hidokarbon alisiklik dan hidrokarbon aromatik. yang termasuk hidrokarbon – alifatik yaitu alkana, alkena dan alkuna – alisiklik yaitu sikloalkana dan sikloalkena (pd gbr salah) – aromatik yaitu benzena dan turunannya. Berikut pembagian atom karbon dan hidrogen dalam senyawa hidrokarbon:
- Atom karbon primer (1º) yaitu atom karbon yang mengikat langsung 1 atom karbon lain dan hidrogen yang terikat pada karbon primer disebut hidrogen primer (H1).
- Atom karbon sekunder (2º) yaitu atom karbon yang mengikat langsung dengan 2 atom karbon dan hidrogen yang terikat pada karbon primer disebut hidrogen sekunder (H2).
- Atom karbon tersier (3º) yaitu atom karbon yang mengikat langsung dengan 3 atom karbon dan hidrogen yang terikat pada karbon tersier disebut hidrogen tersier (H3).
- Atom karbon kuarterner (4º) yaitu atom karbon yang mengikat langsung dengan 4 atom karbon.
ALKANA
alkana disefinisikan sebagai salah satu hidrokarbon alifatik jenuh yaitu hidrokarbon dengan rantai terbuka dan semua ikatan antar atom karbonnya merupakan ikatan tunggal. Rumus umum alkana yaitu : CnH2n+2 ; n = jumlah atom C. dari rumus umum ini jika diketahui jumlah atom karbon maka jumlah H dapat ditentukan demikian pula sebaliknya. Nama-nama beberapa alkana tidak bercabang yang sering disebut sebagai deret homolog dapat dilihat pada tabel.
| Nama | Rumus molekul | Nama | Rumus molekul |
| metana | CH4 | heksadekana | C16H34 |
| etana | C2H6 | heptadekana | C17H36 |
| propana | C3H8 | oktadekana | C18H38 |
| butana | C4H8 | nonadekana | C19H40 |
| pentana | C5H12 | eikosana | C20H42 |
| heksana | C6H14 | heneikosana | C21H44 |
| heptana | C7H16 | dokosana | C22H46 |
| oktana | C8H18 | trikosa | C23H48 |
| nonana | C9H20 | tetrakosana | C24H50 |
| dekana | C10H22 | pentakosana | C25H52 |
| undekana | C11H24 | keksakosana | C26H54 |
| dodekana | C12H26 | heptakosana | C27H56 |
| tridekana | C13H26 | oktaoksana | C28H58 |
| tetradekana | C14H30 | nonakosana | C29H60 |
| pentadekana | C15H32 | trikontana | C30H62 |
Sifat Alkana
Alkana yang memiliki berat molekul rendah yaitu metana, etana, propana dan butana pada suhu kamar dan tekanan atmosfer berwujud gas, alkana yang memiliki 5-17 atom karbon berwujud cair dan selebihnya berwujud padat.
Alkana merupakan senyawa nonpolar sehingga sukar larut dalam air tetapi cenderung larut pada pelarut-pelarut yang nonpolar seperti eter. Jika alkana ditambahkan pada air alkana akan berada pada lapisan atas, hal ini disebabkan adanya perbedaan massa jenis antara air dan alkana. Sebagian besar alkana memiliki massa jenis lebih kecil dari massa jenis air. Karena alkana merupakan senyawa nonpolar sehingga alkana yang berwujud cair pada suhu kamar merupakan pelarut yang baik untuk senyawa-senyawa kovalen.
Untuk alkana-alkana yang berantai lurus titik leleh dan titik didih makin tinggi seiring bertambahnya massa molekul molekul. Pada molekul-molekul alkana terjadi gaya van der Wals. Oleh karena itu alkana memiliki titik leleh dan titik didih yang lebih rendah dibanding senyawa semipolar atau senyawa polar dengan berat molekul yang hampir sama.
Beberapa sifat fisika alkana dapat dilihat pada tabel.
| Nama | Titik leleh (ºC) | Titik didih (ºC) | Massa jenis (g/Cm3) |
| MetanaEtanaPropana Butana Pentana Heksana Heptana Oktana Nonana Dekana | -182-183-188 -138 -130 -95 -91 -57 -51 -30 | -162-89-420 36 69 98 126 151 174 | 0,423054505010 573 0,526 0,655 0,684 0.703 0.718 0.730 |
Alkana merupakan senyawa nonpolar yang tidak bereaksi dengan sebagian besar pereaksi. Hal ini disebabkan alkana memiliki ikatan sigma yang kuat antar atom karbon. Pada kondisi tertentu alkana dapat bereaksi dengan oksigen dan unsur-unsur halogen.
Apabila jumlah oksigen tersedia cukup memadai alkana akan teroksidasi sempurna menjadi karbon dioksida dan uap air serta pelepasan sejumlah energi panas. Apabila jumlah oksigen yang tersedia tidak mencukupi, hasil reaksi yang diperoleh berupa karbon monooksida dan uap air.
Alkana dapat bereaksi dengan halogen dikatalisis oleh panas atau sinar ultraviolet. Dari reaksi tersebut terjadi pergantian 1 atom H dari alkana terkait. Namun apabila halogen yang tersedia cukup memadai atau berlebih, maka terjadi pergantian lebih dari satu atom bahkan semua atom H digantikan oleh halogen. Berdasarkan penelitian laju pergantian atom H sebagai berikut H3 > H2 > H1. Reaksi pergantian atom dalam suatu senyawa disebut reaksisubstitusi.
Misalnya
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CH2Cl3 + HCl
- CH2Cl3 + Cl2 → CCl4 + HCl
Isomer Alkana
Alkana yang mempunyai kemampuan membentuk rantai ikatan yang panjang mengakibatkan kemungkinan besar terjadinya isomer struktur. Isomer yaitu dua atau lebih senyawa yang mempunyai rumus molekul sama tetapi mempunyai struktur molekul yang berbeda. Dalam hal ini cara terikatnya atom-atom dalam molekul berbeda. Pada alkana semakin banyak jumlah atom karbon maka jumlah isomer struktur yang terbentuk akan makin banyak. Pada 3 suku alkana yang pertama tidak memiliki isomer karena atom karbon yang dimiliki berjumlah sedikit sehingga atom karbon terikat pada atom karbon yang mana saja akan tetap memberikan nama yang sama. Tiga suku alkana tersebut yaitu metana, etana, dan propana.
SIKLOHEKSANA
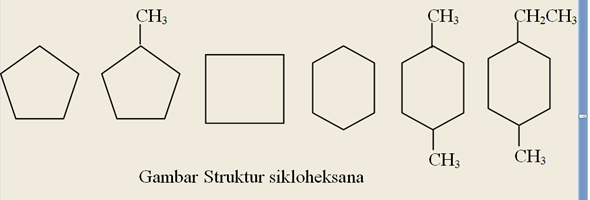
Selain alkana rantai terbuka dikenal pula alkana dengan rantai tertutup yang sebut sikloalkana. Perbedaan alkana dan sikloalkan yaitu atom alkana memiliki rantai yang terbuka sedangkan sikloalkan memiliki rantai yang tertutup menyerupai cincin. Struktur rantai yang menyerupai cincin ini merupakan ciri khas senyawa-senyawa siklik. Rumus umum sikloalkana yaitu CnH2n. Dari rumus umum tersebut diketahui bahwa sikloalkana memiliki dua atom hidrogen lebih sedikit dibandingkan dengan alkana yang memiliki jumlah atom karbon sama. Sikloalkana digolongkan sebagai hidrokarbon alisiklik. Sebab walaupun memiliki rantai tertutup namun sifat yang dimiliki mirip dengan alkana yang berantai terbuka. Pemberian nama sikloalkana tidak berbeda jauh dengan pemberian nama pada alkana. Karena pada penamaan sikloalkana hanya menambah awalan siklo pada nama alkana yang bersesuaian. Awalan siklo menandakan adanya rantai tertutup pada alkana terkait. Jika terdapat satu sustituen pada rantai siklik maka penomoran tidak perlu diberikan. Tetapi apabila terdapat lebih dari satu substituen, baik sama maupun berbeda, maka penomoran perlu dilakukan. Untuk substituen yang berbeda penomoran dimulai dari substituen yang mengawali urutan abjad. Di alam sikloalkana terdapat bersama alkana dalam minyak bumi, dengan jumlah atom karbon 3-30. Tetapi yang paling banyak dijumpai adalah cincin beranggota 5 (siklopentana) dan 6 (siklopentana). Penamaan sikloalkana dapat dilihat pada gambar. Dengan nama berturut-turut dimulai dari kiri: siklopentana, metilsikloheksana, siklobutana, sikloheksana, 1,4-dimetilsikloheksana, 1-etil, 4-metilsikloheksana.
beberapa sifat siklopropana dilihat pada gambar
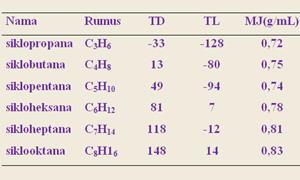
sifat sikloalkana
ALKENA
Alkena atau olefin merupakan senyawa hidrokarbon alifatik tidak jenuh yang sangat reaktif dan memiliki rumus umum CnH2n. Alkena dikatakan tidak jenuh karena memiliki gugus ikatan rangkap antar atom karbon. Terbentuknya ikatan rangkap ini menyebabkan alkena memiliki jumlah H yang lebih sedikit apabila dikaitkan jumlah atom C. Ikatan rangkap yang terdapat pada alkena merupakan ciri khas pada senyawa-senyawa alkena.Untuk hidrokarbon alifatik tidak jenuh yang memiliki dua ikatan rangkap karbon-karbon pada molekulnya dinamakanalkadiena.
Atom-atom karbon yang terlibat dalam ikatan rangkap masing-masing menggunakan 3 orbital hibrida sp2. Tumpang tindih (overlap) 3 orbital hibrida sp2 antara atom karbon menghasilkan ikatan sigma dengan tiga atom lain. Ketiga orbital hibrida sp2 terletak dalam satu bidang dan membentuk sudut 120º. Masing-masing atom karbon masih mempunyai orbital 2p yang tidak terlibat dalam pembentukan hibridisasi sp2. Tumpang tindih orbital 2p ini menghasilkan ikatan pi, yaitu suatu orbital molekul di atas dan di bawah sumbu ikatan karbon-karbon. Dengan demikian rangkap karbon-karbon terdiri dari sebuah ikatan sigma (σ) dan sebuah ikatan pi (π).
Sifat-Sifat Alkena
Sifat Fisika
Alkena merupakan senyawa nonpolar sehingga tidak larut dalam air dan memiliki massa jenis lebih kecil dari air. Alkena dapat larut dalam alkena lain, pelarut-pelarut nonpolar dan etanol. Pada temperatur kamar alkena yang memiliki dua, tiga dan empat atom karbon berwujud gas. Sedangkan Alkena dengan dengan berat molekul lebih tinggi dapat berupa cair dan padatan pada suhu kamar.
| Nama | Rumus molekul | Titik leleh (°C) | Titik didih (°C) | Massa jenis(g/cm3) |
EtenaPropena1-Butena
1-Pentena
1-Heksena
1-Heptena
1-Oktena
1-Nonesa
1-Dekena
| C2H4C3H6C4H8
C5H10
C6H12
C7H14
C8H16
C9H18
C10H20
| -169-185-185
-165
-140
-120
-102
-81
-66
| -104-48-6
30
63
94
122
147
171
| 0,5680,6140,630
0,643
0,675
0,698
0,716
0,731
0,743
|
Sifat kimia
Ikatan rangkap yang dimiliki alkena merupakan ciri khas dari alkena yang disebut gugus fungsi. Reaksi terjadi pada alkena dapat terjadi pada ikatan rangkap dapat pula terjadi diluar ikatan rangkap. Reaksi yang terjadi pada ikatan rangkap disebut reaksi adisi yang ditandai dengan putusnya ikatan rangkap (ikatan π) membentuk ikatan tunggal (ikatan α) dengan atom atau gugus tertentu.
Selain sifat-sifat tersebut dapat mengalami reaksi polimerisasi dan alkena juga dapat bereaksi dengan oksigen membentuk korbondioksida dan uap air apabila jumlah oksigen melimpah, apabila jumlah oksigen tidak mencukupi maka terbentuk karbonmonooksida dan uap air.
ALKUNA
Alkuna yaitu golongan senyawa hidrokarbon alifatik yang mempunyai gugus fungsi ikatanganda tiga karbon-karbon (─C ≡ C─). Seperti halnya ikatan rangkap dua pada alkena, ikatan ganda tiga pada alkunapun disebut ikatan tidak jenuh, tetapi kejenuhan ikatan ganda tiga pada alkuna lebih tinggi dibanding ikatan rangkap. Tatanama AlkunaSistem IUPAC
- Pemberian nama pada alkuna menyerupai tata nama elkana yakni mengganti akhiran –ana pada alakan terkait dengan akhiran –una. 2)
- Rantai atom karbon terpanjang adalah rantai atom karbon yang mengandung ikatan ganda tiga 3)
- Penomoran dimulai dari salah satu ujung rantai yang memungkinkan ikatan ganda tiga mempunyai nomor serendah mungkin. 4)
- Pada penulisan nama, atom C yang mengandung atom ikatan ganda tiga ditunjukan dengan nomor. NamaUmum Nama umum digunakan untuk alkuna-alkuna sederhana. Dalam pemberian nama umum alkuna dianggap sebagai turunan asetilena (C2H2) yang satu atom hidrogennya diganti oleh gugus akil. Contoh
- H C ≡ C─C2H5 (etil asetilena)
- H3C─C ≡ C─CH3 (dimetilasetilena)
Struktur Alkuna
Alkuna merupakan molekul linear dan semua sudut ikatan adalah sebesar 180°. Etuna merupakan alkuna paling sederhana. Rumus struktur alkuna seperti berikut ini H – C ≡ C – H etuna
Sifat Fisika Alkuna
- Alkuna-alkuna suku rendah pada suhu kamar berwujud gas, sedangkan yang mengandung lima atau lebih atom karbon berwujud gas.
- Memiliki massa jenis lebih kecil dari air.
- Tidak larut dalam air tetapi larut dalam pelarut-pelarut organik yang non polar seperti eter, benzena, dan karbon tetraklorida.
- Titik didih alkuna makin tinggi seiring bertambahnya jumlah atom karbon, tetapi makin rendah apabila terdapat rantai samping atau makin banyak percabangan. Titik didih alkuna sedikit lebih tinggi dari alkana dan alkuna yang berat molekulnya hampir sama.














